francesco triccoli ci parla di fitness e wellness e alimentazione
Sommario:
- Cos'è un ciclo chiuso ibrido?
- Specifiche del prodotto ridotto al minimo 670G
- Disponibilità e costi
- 'Un momento di spartiacque … Trasformare la cura del diabete'
- La FDA approva Libre Pro
- Disclaimer
Wow, che grande momento per la comunità del Diabete!
Mercoledì, la FDA ha approvato il Minimated 670G di Medtronic, il primo "sistema ibrido a circuito chiuso" in grado di monitorare automaticamente il glucosio e regolare le dosi basali di insulina nelle persone di 14 anni e oltre con diabete di tipo 1.

Mentre noi nella comunità del Diabete realizziamo che non è un AP a circuito chiuso che prende completamente il controllo del diabete, e lo stesso Medtronic sta facendo attenzione a definirlo un "ibrido", il nuovo Il 670G ridotto rappresenta un enorme passo in avanti nell'automazione della gestione della malattia. Woot!
Ecco la lettera ufficiale della FDA a Medtronic su questa liquidazione, così come il comunicato stampa della FDA.
Sorprendentemente, questa approvazione regolamentare arriva a soli 104 giorni (!) Dopo che Medtronic ha inviato migliaia di pagine di documenti, sette mesi prima del previsto e questa approvazione supera più di un decennio di ricerca, politica, e lo sviluppo del prodotto per raggiungere questo traguardo.
"Questo è fenomenale, e io sono così eccitato! "Dice Aaron Kowalski, Chief Mission Officer della JDRF e di lunga data di tipo 1. "È incredibile essere a questo livello. Pensaci: questa è la prima volta che uno di questi (sistemi automatici) è stato approvato … e il tempo breve impiegato dalla FDA per risolverlo. "
Quindi, che cos'è questo nuovo sistema di controllo della glicemia e come funziona?
Cos'è un ciclo chiuso ibrido?
Il termine "ibrido" in questo caso indica che il sistema è parzialmente automatizzato ma richiede ancora un certo controllo da parte dell'utente.
Il modo in cui funziona è che il sensore CGM legge i dati del glucosio ogni cinque minuti e l'algoritmo a circuito chiuso incorporato nella pompa utilizza tali informazioni per aumentare o diminuire l'insulina basale per mantenere i livelli di glucosio il più vicino possibile all'obiettivo di 120 mg / dL: gli utenti devono ancora inserire i conteggi di carboidrati e le quantità di bolo per i pasti e avvisare il sistema prima di qualsiasi esercizio.Inoltre non fornisce boli di correzione automatici basati su CGM, ma suggerisce quantità di correzione quando un risultato del polpastrello è inserito come tutte le pompe standard di insulina ora attraverso la funzione Bolus Wizard.
< ! --1 ->Questa pagina FDA fa un buon lavoro spiegando i dettagli. Il sistema MiniMed 670G ha due modalità, una in più "autopilota" rispetto all'altra, ma entrambe richiedono l'intervento dell'utente (quindi non un circuito completamente chiuso):
Modalità manuale - in cui il sistema può essere programmato dal utente di consegnare l'insulina basale ad un tasso costante pre-programmato.Il sistema sospenderà automaticamente la somministrazione di insulina se il valore glicemico del sensore scende al di sotto o si prevede che scenda al di sotto di una soglia predeterminata. Il sistema riprenderà automaticamente la somministrazione di insulina quando i valori glicemici del sensore saliranno al di sopra o si prevede che aumentino al di sopra di una soglia predeterminata.
Modalità automatica - il sistema può regolare automaticamente l'insulina basale aumentando, diminuendo o sospendendo in modo continuo la somministrazione di insulina in base ai valori CGM (diversi dalla modalità manuale in cui l'insulina basale viene erogata a una costante Vota). Sebbene la Modalità automatica possa regolare automaticamente la somministrazione di insulina basale senza input da parte dell'utente, l'utente deve comunque somministrare manualmente l'insulina durante i pasti.
Questo è un nuovo tipo di dispositivo mai visto prima sul mercato - e il fatto che sia stato approvato qui in U. S. prima, prima di colpire i mercati europei e internazionali, difficilmente può essere esagerato.
Specifiche del prodotto ridotto al minimo 670G
Esteriormente, il modello 670G ridotto ha un aspetto quasi identico al Minimed 630G recentemente approvato della società che offre un nuovo orientamento verticale e schermo a colori al design standard della pompa di Medtronic.

La grande differenza è che questa combo di pompa per insulina-CGM è controllata da un sofisticato algoritmo che Medtronic denota la sua "tecnologia SmartGuard Hybrid Closed Loop", che può apportare quelle regolazioni automatiche all'insulina basale e allo spegnimento automatico quando necessario. Le specifiche del prodotto sono le seguenti:
- Unità pompa: Come notato, l'aspetto è lo stesso del Minimed 630G introdotto lo scorso mese (già obsoleto?). Stessa batteria AA, stesso set di infusione e serbatoio di insulina da 300 unità, e un po 'più grande delle pompe Minimed in stile tradizionale con il loro orientamento orizzontale. In contrasto con le precedenti pompe Medtronic, questo dispositivo viene offerto solo in nero, ma è possibile acquistare un certo numero di skin diverse per tonificare il look se lo si desidera.
- Pulsanti e menu: Le uniche piccole differenze tra il 630G e il nuovo MiniMed 670G sono il fatto che il pulsante in alto a destra ti porta direttamente ai grafici CGM, rispetto al percorso dei menu, e il menu stesso differisce un po ' , date le nuove scelte di modalità, ecc., sul nuovo sistema.
- Schermo a colori: Come il 630G, il nuovo sistema sfoggia anche uno schermo a colori (!) Che si adatta automaticamente alle situazioni di illuminazione, quindi ad esempio di notte non si illumina così intensamente come potrebbe durante il giorno. Questo sembra essere molto più facile da leggere, un grande vantaggio per chiunque abbia disabilità visive, ovviamente. Insieme alla pompa di base e ai dati CGM, Insulin on Board (IOB) viene visualizzato direttamente sulla schermata principale - qualcosa a cui gli utenti hanno chiesto a gran voce.
- CGM Tech: Il nuovo sistema utilizza il sensore CGM di quarta generazione di Medtronic a forma di conchiglia, che era stato indicato come Enlite 3 ma che ora sarà conosciuto come il sensore Guardian 3 ( abbiamo una carrellata di tutti i diversi termini di Medtronic su Storify ). E 'autorizzato dalla FDA a indossare sul corpo per 7 giorni, rispetto ai 6 giorni per le generazioni precedenti.Nulla di nuovo sul fronte adesivo, però.

- Precisione migliorata: Il Guardian 3 è più affidabile e preciso, dice Medtronic, perché utilizza un nuovo segnale radio (introdotto con il 630G) per comunicare tra il trasmettitore e il sensore. In base ai dati clinici sperimentali della società su due calibrazioni al giorno, il tasso di errore MARD è in media pari a 10. 55%, che non è buono come l'ultimo Dexcom G5 al 9% ma è molto meglio del ~ 14% del l'attuale Enlite ha da offrire - quindi questo è un potenziale punto di svolta nel far diventare Medtronic un concorrente più forte nel mercato CGM!
- La tua modalità può variare: Medtronic dice di aver ascoltato le persone sulla possibilità di scelta, quindi consente di passare da una modalità all'altra: Modalità automatica per la funzione ibrida a circuito chiuso o Modalità manuale che offre ancora la funzionalità Sospendi su bassa per quando si supera questa soglia di ipo (come il 530G e il 630G hanno entrambi), e Suspend Before Low può essere impostato per prevedere gli hypo 30 minuti prima che si verifichino (come nel 640G disponibile a livello internazionale).

- Imposta target BG: Questa tecnologia è progettata per "trattare a target", il che significa che lavora per mantenere i livelli di BG il più vicino possibile a 120 mg / dL. Sfortunatamente, questo non può essere cambiato … il che significa che Medtronic accetta solo la "personalizzazione e personalizzazione" finora. L'utente può impostare un obiettivo temporaneo di 150 mg / dL per un massimo di 12 ore per affrontare situazioni come l'esercizio fisico, ma questa è l'unica flessibilità incorporata. Medtronic afferma che questo era il risultato del tentativo di arrivare sul mercato in primo luogo, perché consentire obiettivi diversi sarebbe significa studi clinici molto più ampi che avrebbero ritardato l'approvazione e la commercializzazione regolamentari. Le generazioni future probabilmente permetteranno livelli di obiettivo diversi, dice Medtronic.
- Nessuna condivisione dati: Come il precedente sistema Minimed 630G, questo 670G Hybrid Closed Loop non ha Bluetooth integrato e non funziona con Minimed Connect per la condivisione dei dati dei telefoni cellulari ( ?!). Per coloro che desiderano la condivisione dei dati, Medtronic punta le persone verso il loro sistema Minimed 530G che ora ha più di tre anni. A causa di questa mancanza di connettività, la 670G non funzionerà con nessuna delle app mobili Watson o di condivisione dei dati in fase di sviluppo.
- Connected BG Meter: Il sistema è configurato per comunicare direttamente con Bayer Contour Link 2. 4 Meter che Ascensia ha introdotto con l'annuncio di lancio 630G. Ciò consente di eseguire il bolus remoto dallo strumento, ma solo in modalità manuale anziché in modalità automatica a circuito chiuso.
- Due calibrazioni al giorno: Il sistema richiede almeno una calibrazione del polpastrello ogni 12 ore e, se non inserito, esclude automaticamente l'utente dalla modalità automatica.
- One-Press Serter: Il 670G utilizza il nuovo Sertrico One-Press di Medtronic che dice che renderà l'inserimento del sensore più facile e più comodo. Richiede solo un singolo pulsante, rispetto al generatore di generazione precedente che era più voluminoso e richiedeva due pressioni di pulsante (una volta da inserire e una volta per ritrarre).
- Bambini e ragazzi: Il 670G ridotto al minimo è etichettato ufficialmente a partire da 14 anni, ma la società afferma che sta già conducendo prove per l'approvazione nei bambini tra 7 e 13 anni, oltre a studi di fattibilità per bambini di 2 anni. L'attuale lettera di approvazione della FDA afferma specificamente che il 670G non deve essere usato nei bambini di età inferiore ai 7 anni, né in quelli che prendono meno di 8 unità di insulina al giorno (poiché il dispositivo richiede quel minimo al giorno per operare in sicurezza). Metronic dice che non ha abbastanza dati in coloro che prendono meno di 8 unità al giorno per sapere se l'algoritmo è efficace e sicuro.
Disponibilità e costi
Con l'approvazione normativa molto più rapida del previsto, Medtronic ci dice che hanno bisogno di almeno sei mesi per prepararsi al lancio del prodotto negli Stati Uniti a partire dalla primavera 2017. Per quelli al di fuori degli Stati, dice Medtronic aspettarsi l'approvazione normativa a metà 2017.
Ci sono molte "parti mobili" che devono essere installate in pre-lancio qui in America, spiegano, inoltre sono attualmente nel bel mezzo del lancio del Minimed 630G; quel modello precedente ha iniziato di recente la spedizione ai pazienti nel Regno Unito
Sì, ci sarà un percorso di aggiornamento per chiunque usi gli attuali prodotti Medtronic - chiamato Priority Access Program. In realtà sta incoraggiando i clienti a iniziare con il 630G ridotto nei prossimi mesi prima che il 670G colpisca il mercato, pubblicizzando che una transizione del genere aiuterà i pazienti a prepararsi per la nuova piattaforma e potenzialmente a ridurre i loro costi al minimo a $ 0.
- Costo iniziale del programma di accesso prioritario = $ 799
- Credito di permuta sulla pompa MiniMed 630G e sistema CGM = $ 500
- Costo totale del programma tascabile = solo $ 299
- La partecipazione a sondaggi e altri programmi di feedback degli utenti può anche ridurre questo costo, a partire da $ 0 per alcune persone, la società afferma
Il programma di accesso prioritario viene eseguito fino al 28 aprile 2017. Medtronic dice anche che più offerte e possibilità di aggiornamento potrebbero rivelarsi più vicine al tempo di lancio in primavera.
Naturalmente, Medtronic lavorerà anche nei prossimi mesi con i pagatori e le compagnie di assicurazione sulla copertura di questa tecnologia. Con tutte le recenti controversie su questi argomenti (#DiabetesAccessMatters), ci auguriamo che Medtronic tenga presente che mentre molti pazienti vorranno questo sistema, potrebbe non essere la scelta migliore per tutti - e le questioni relative alla scelta!
'Un momento di spartiacque … Trasformare la cura del diabete'
Mercoledì la JDRF ha rilasciato un comunicato stampa, esprimendo entusiasmo per questa tecnologia fondamentale e quanto velocemente la FDA si è trasferita. L'American Diabetes Association è intervenuta anche con un comunicato stampa su questa approvazione, rilevando il suo significato.
Pensaci: dieci anni fa, molti pensavano ancora che un sistema a circuito chiuso di qualsiasi tipo fosse un miraggio. Ma JDRF ha tracciato un vero e proprio progetto per spostarsi verso un pancreas artificiale. Erano ancora i primordi della tecnologia CGM … e guardiamo fino a che punto siamo arrivati!
"Questo si è mosso incredibilmente velocemente, e mostra quanto sia stato importante tutto il duro lavoro svolto nel settore, per creare una guida per questi sistemi", ha detto Kowalski, che personalmente ha svolto un ruolo importante nel rendere lo sviluppo tecnologico di AP una priorità."Questo ha cambiato tutto e creato un percorso, e ora siamo qui: è un momento massiccio, davvero spartiacque che ha il potenziale per trasformare la cura del diabete!"
Sia che consideriate il Minimated 670G un "Pancreas Artificiale" o non lo sia quasi oltre il punto … Il fatto è che ora abbiamo un dispositivo che sta chiudendo il circuito in modi che non abbiamo mai visto prima, costituendo una prima generazione di AP. È potenzialmente una tecnologia che cambia la vita che è stata resa disponibile in tempi record.

In effetti, la FDA ha dato l'approvazione del mercato per questo 670G ridotto, richiedendo anche ulteriori studi post-mercato per capire meglio come funziona il dispositivo in situazioni reali. Ciò dimostra che la FDA è disposta a esaminare i dati esistenti e ad affidarsi ai benefici, senza trattenere le risme di dati futuri.
Il viaggio è davvero sorprendente, come è stato catturato in questo post da D-Mom e da molto tempo JDRF sostenendo Moira McCarthy Stanford su come l'organizzazione ha aperto la strada a questo traguardo e oltre.
Abbiamo anche parlato con Jeffrey Brewer, che dirige Bigfoot Biomedical che sta sviluppando un proprio sistema a circuito chiuso che dovrebbe essere disponibile nel 2018. Insieme a Aaron Kowalski, Brewer è considerato uno dei "Padri dell'AP" dato il loro ruolo nell'aiutare a sviluppare e promuovere il percorso ad anello chiuso presso la JDRF.
"Siamo entusiasti che la FDA si muova più velocemente e sia più favorevole ai sistemi di somministrazione automatica dell'insulina e cerchiamo di essere aiutati dagli stessi venti!" Brewer ci ha detto.
Senza dubbio, questo farà muovere l'ago in avanti sugli oltre 18 altri sistemi a circuito chiuso in lavorazione, specialmente quelli che usano solo l'insulina. Alcuni aggiungono l'ormone glucagone aggiuntivo al mix per combattere l'ipoglicemia (come Beta Bionics iLET e Pancreum Genesis), che potrebbe richiedere più tempo per la valutazione della FDA.
Siamo felici di sentire che i nostri amici all'interno della comunità del fai-da-te di #OpenAPS sono anche entusiasti di questa nuova approvazione e di cosa significa per tutti noi.
È bello vedere la FDA muoversi così in fretta, non solo con questa approvazione ridotta a 670G, ma con altri entusiasmanti sviluppi della tecnologia e dei dati del diabete negli ultimi anni. Chiaramente, la FDA sta riconoscendo il movimento #WeAreNotWaiting e sta facendo del suo meglio per tenere il passo con questi tempi rapidi.
La FDA approva Libre Pro
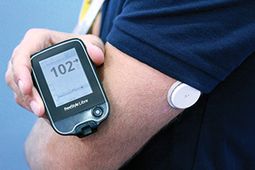
Questo non è un dispositivo consumer, ma la versione clinica di Abbott's nuova tecnologia Flash Glucose Monitoring (FGM) già disponibile per i pazienti all'estero.
Conosciuto anche come sistema "ibrido" - ma solo per il monitoraggio del glucosio - Abbott Libre è costituito da un piccolo sensore rotondo indossato fino a 14 giorni sul retro del braccio e da un controller che gli utenti passano semplicemente su di esso tante volte al giorno, se necessario o desiderato, per ottenere letture glicemiche senza fili.
Non offre allarmi per aumentare o ridurre i livelli di glucosio e la versione per consumatori all'estero memorizza solo 8 ore di dati.L'obiettivo è quello di creare una soluzione di monitoraggio più semplice che potrebbe anche aiutare molti tipi 2 a essere più in contatto con i loro livelli di glucosio in tempo reale.
Sebbene non sia un CGM tradizionale come lo conosciamo, Abbott dice che le regole di regolamentazione classificano Libre come CGM. E ciò che hanno approvato ora è una versione progettata specificamente per i medici che prestano ai loro pazienti per un uso a breve termine e fornisce solo dati ciechi che i medici possono visualizzare. È un primo passo verso la versione consumer, che Abbott ha anche recentemente depositato per l'approvazione della FDA qui negli Stati Uniti.
Speriamo che arriverà presto, con l'accelerazione dell'innovazione apparentemente aggravata dalla FDA.
Un enorme ringraziamento a tutte le persone coinvolte, non ultime quelle della FDA, per aver spostato questi importanti strumenti per la cura del diabete in tutti i nostri migliori interessi!
Disclaimer : Contenuto creato dal team Diabetes Mine. Per maggiori dettagli clicca qui.Disclaimer
Questo contenuto è stato creato per Diabetes Mine, un blog sulla salute dei consumatori incentrato sulla comunità dei diabetici. Il contenuto non è revisionato da un medico e non aderisce alle linee guida editoriali di Healthline. Per ulteriori informazioni sulla partnership di Healthline con Diabetes Mine, fare clic qui.
Pompe di patch cGM +: strisciamento verso il circuito chiuso

Un sistema a circuito chiuso per il controllo del diabete | DiabetesMine

Scopri TypeZero Technologies, una nuova startup che sviluppa un sistema di Pancreas artificiale basato sulla ricerca dell'Università della Virginia (UVA).
Uno sguardo più approfondito a 670G ridotto di Medtronic | DiabetesMine

Wil Dubois completa il suo periodo di prova di tre mesi della nuova tecnologia del diabete Hybrid Closed Loop di Medtronic e ha alcune opinioni contrastanti su questo dispositivo.



